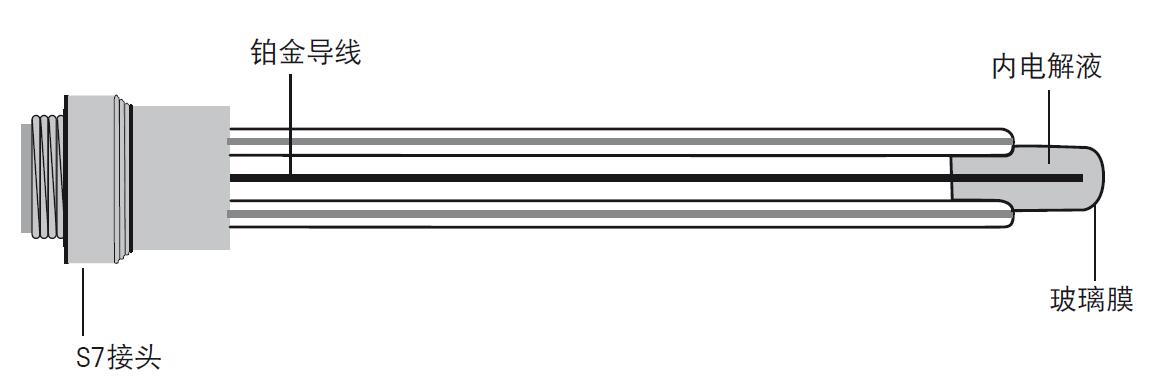实验室pH测量原理与应用(一)
2020.07.22 点击12025次
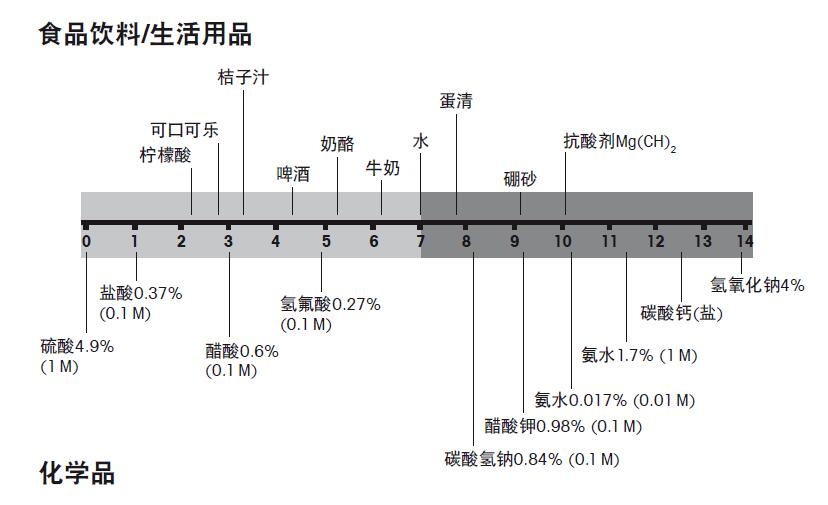
1、pH测量入门 1.1 酸性或碱性 为什么我们把醋列为酸类?原因是醋中含有过量的水合氢离子(H3O+),溶液中过量的水合氢离子,会使溶液呈酸性。相反含有过量氢氧根离子(OH–)的溶液,则呈碱性。在纯水体系中水合氢离子和氢氧根离子相互中和。我们称这种溶液的pH 值为中性。 H3O+ + OH– ↔ 2 H2O 图1. 酸与碱形成水的反应 凡是能释放出氢离子或质子的物质叫酸,此溶液即为酸性。盐酸、硫酸、醋酸或醋是一些众所周知的酸。以下是醋酸的分解式: CH3COOH + H2O ↔ CH3COO– + H3O+ 图2. 醋酸的分解式 不是每一种酸的酸性都一样强。溶液的确切酸度,是由溶液中氢离子总数所决定的。pH值被定义为溶液中氢离子浓度的负对数(准确地说,pH是由溶液中氢离子的活度所决定)。 pH = –log [H3O+] 图3. pH值计算公式 通过pH值测量,物质的酸碱度可以进行量化。图4列出了一些日常用品和化学制品的pH值。
图4. 日常用品和化学品的pH 值 pH 7至14属于碱性范围,在此范围中氢氧根离子(OH-)过量。这种溶液的pH值是由溶于水溶液的碱基所造成的,碱基分解释放出的氢氧根离子使溶液呈碱性。氢氧化钠、氨水和碳酸盐是众所周知的碱。 NH3 + H2O ↔ NH4+ + OH– 图5. 氨和水的反应式 水溶液的pH范围包括酸性范围和碱性范围,数值从0至14。pH 0至7称为酸性, pH7至14称为碱性,pH为7时,则称为中性。 1.2 为什么需要测量pH 测量pH主要有以下几个原因: • 制造性质稳定的产品 – 生产过程中,为了确保得到所期望的产品,调控pH值至关重要。pH值能明显的改变最终产品的性状与口味。 • 减少生产成本 – 这和上述的原因相关。如果在特定的pH,产量能达到最高,当然生产的成本自然就节约了。 • 减少对人类、资产和环境的危害 – 有些产物在特定的pH会产生危害性。为了保护人类与资产的安全,我们对排放到环境中的有害物质应严格控制。判断物质是否有危害性,第一步就是测量它的pH 值。 • 实现管理法规的要求 – 如上所述,一些产物具有危害性。政府机构为保护人民免受危险物质的伤害,制订相应的管理法规。 • 保护设备、设施 – 生产线上一些生产设备直接和反应物接触,如果不适当地控制pH值,就会造成设备腐蚀。因此为了避免腐蚀造成的生产线寿命减短,我们应该对pH 进行监控。 • 进行研发 – 在研发过程中,比如研究生物化学工艺,pH值是一个非常重要的参考参数,往往会影响最后研究的成果。 以上这些例子介绍了各种应用中pH 的重要性,解释了pH为什么需要测量。 1.3 pH测量工具 测量pH必须使用对氢离子敏感的指示电极。测量的原理是使用一个对氢离子感应的玻璃膜电极,检测电极与样品溶液间产生的信号。然而,单单有pH电极的指示电位是不够的,我们还需要第二电极。第二电极可以为指示电极提供稳定的参比信号或电位。 测量pH值必须一起使用这两种不同电位的电极。pH电极根据氢离子浓度而产生电信号,电信号的大小决定了溶液的酸碱度。 参比电极则对氢离子浓度无响应,因此可以为pH指示电极提供相同、稳定的电位。两电极间的电位可决定溶液的pH值,即溶液中氢离子的数量。电位与溶液中氢离子浓度呈线性函数关系,函数公式见图6: E = E0 + 2.3RT / nF × log [H3O+] E = 测量电位 E0 = 常数 R = 气体常数 T = 开氏温度 n = 离子价数 F = 法拉第常数 图6. 溶液中氢离子浓度与pH电极的输出电位的关系。
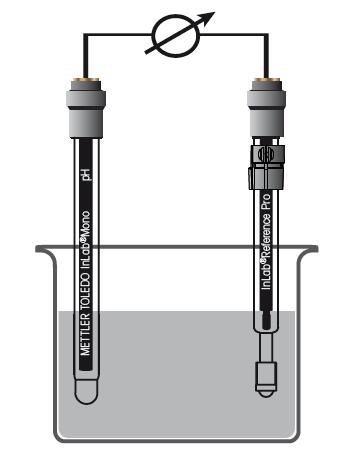
图7. pH电极和参比电极测量 图7中 pH测量由两个独立的电极组成,如图中的pH指示电极和参比电极。如今两个独立的电极合并为一支复合电极已经十分普遍。 这三种电极各有特点和其应用领域。 a) pH电极 pH电极是直接响应溶液中pH的部分。它由玻璃杆和底端的玻璃氢离子敏感膜组成。敏感膜与水性溶液接触时,其外部会形成一层凝胶层。同时由于电极内部充满水性电解质溶液,膜内部也有一层凝胶。凝胶层的实例请见下图:
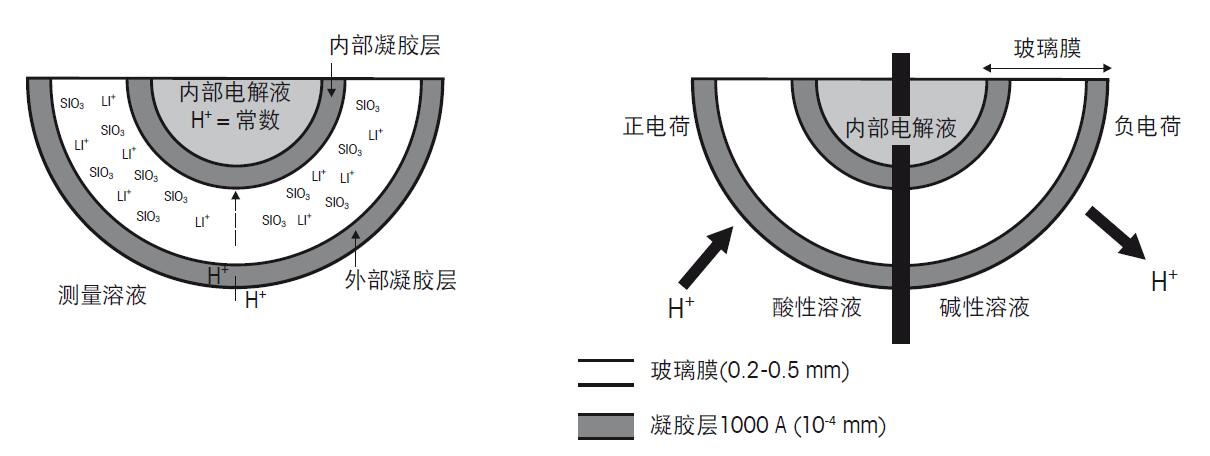
图8. 玻璃膜界面图 凝胶层内和周围的氢离子根据测试溶液中氢离子的浓度即pH不同,会发生渗出或渗入凝胶层。如果溶液是碱性的,H+会向外渗出,膜外就形成了负电荷。由于玻璃电极内部的电解液拥有恒定的pH值,测量过程中膜内部表面的电位保持恒定。如此造成了pH电极的内部和外部的电荷不同。标准pH电极示意图如图9所示。
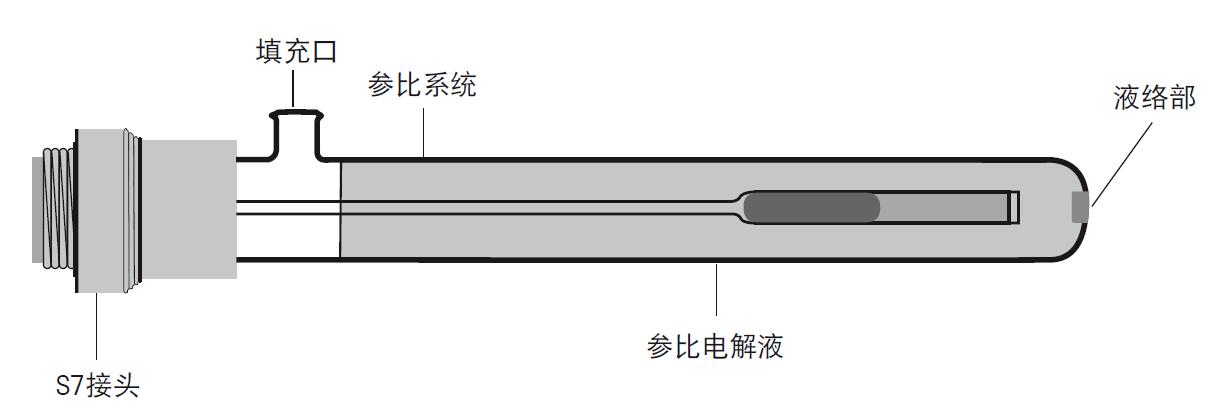
图9. 标准pH电极的结构图 b) 参比电极 参比电极可以为pH电极的电位的测量提供一个确切、稳定的参比电位。为了达到这个目的,参比电极需要由对H+无感应的玻璃制成。并且参比电极浸入样品溶液时填充口必须保持敞开。为此参比电极上需制成开放式或接触式液络部,确保内部溶液或参比电解液能渗入样品中。正确的测量时,参比电极和pH半电池必须浸入相同的溶液中。以下是典型的参比电极结构图:
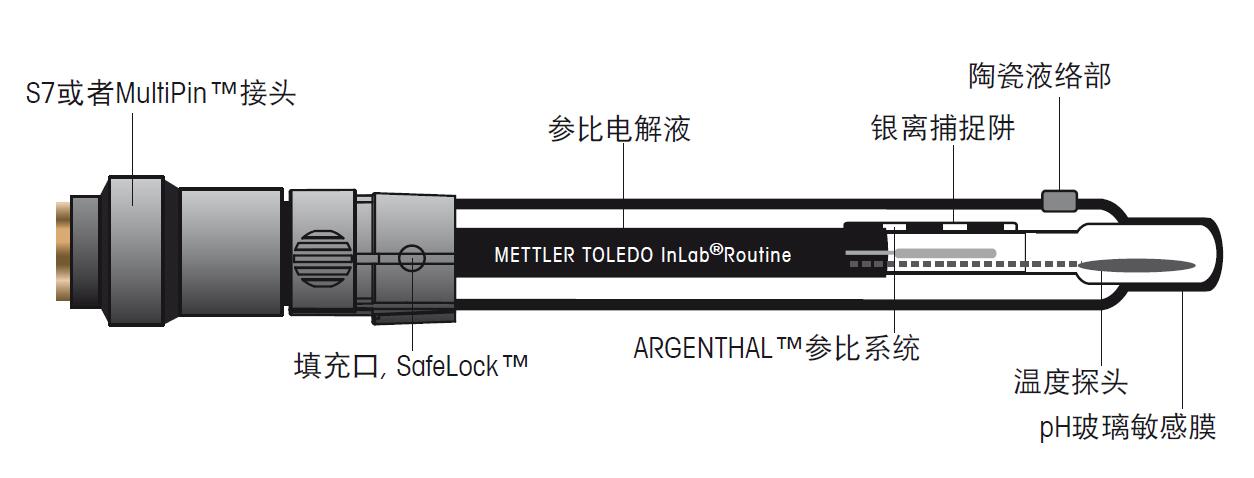
图10. 参比电极包括参比电解液、参比导线和液络部 电极的结构包括浸没在确定的内参比电解液中的导线,内参比液通过液络部间接地和样品溶液接触,接触部分可以确保稳定的电位。参比系统共有多种,目前使用最多的是Ag/AgCl参比系统。参比电解液和Ag/AgCl参比导线决定了此参比系统的电位。为了得到系统的低电阻,参比电解液必须保持高离子浓度。 由于测量过程中参比电解液需流入样品溶液,我们必须当心参比电解液与样品溶液发生化学反应,避免化学反应影响电极状态和测量结果。 c) 复合电极 复合电极(图11)比起两个独立的半电池电极,操作更便捷,如今使用非常普遍。复合电极中,pH敏感玻璃电极位于中间,外围被充满了参比电解液的参比电极所包围。复合电极中的pH电极和参比电极部分和独立的电极拥有同样的功能,唯一的区别是把独立的电极整合为一支电极,更便于使用。只有当pH电极和参比电极两者的使用寿命相差很大,才推荐使用独立的电极。 更便捷的电极是在复合电极中加入温度探头,这样就能简单的进行温度补偿,这种电极称为3合1电极。
图11. 典型的复合电极包括内部pH电极和外部参比电极 1.4 正确测量pH指南 pH测量的工具非常简单、易用、只要正确地操作即能得到可靠数据。以下我们将讨论几个重要的指导方针。关于如何得到正确和精确的pH测量的分步测量指导将在本节最后介绍。 a) 样品的准备 当准备样品时,有一点必须考虑,那就是温度。测量样品的温度或保持温度常数在一个已知值是非常必要的。这是因为pH值与温度有关,pH电极给出的是由温度所决定的测量结果。只要记录温度并进行温度补偿,这个问题就能解决了。 开始测量pH之前,搅拌样品确保样品均一性,避免电极所在部位不同,而造成的结果不同。容器中的样品需要足够的量,这样才能把参比电极的液络部完全浸入样品中。必须保证参比电极和外部样品接触,电解液能渗入样品。当然pH测量需要按照GLP的要求使用合适、干净、贴有标签的玻璃器皿。 b) 校准 pH电极需要有规律地进行校准。每天至少校准一次,是最恰当的。校准后可确定电极的斜率和零点。 理论斜率和零点可由 Nernst 方程式得出: E = E0 + 2.3RT / nF × log [H3O+] = E0 – 2.3RT / nF × pH 斜率 = 2.3RT / nF 零点 = 0 mV , pH 7.00时 图12. pH电极的斜率和零点 为了得到正确的测量结果,校准电极的斜率和零点是必不可少的。校准曲线可以使电极测量的mV值与溶液的pH值一一关联。
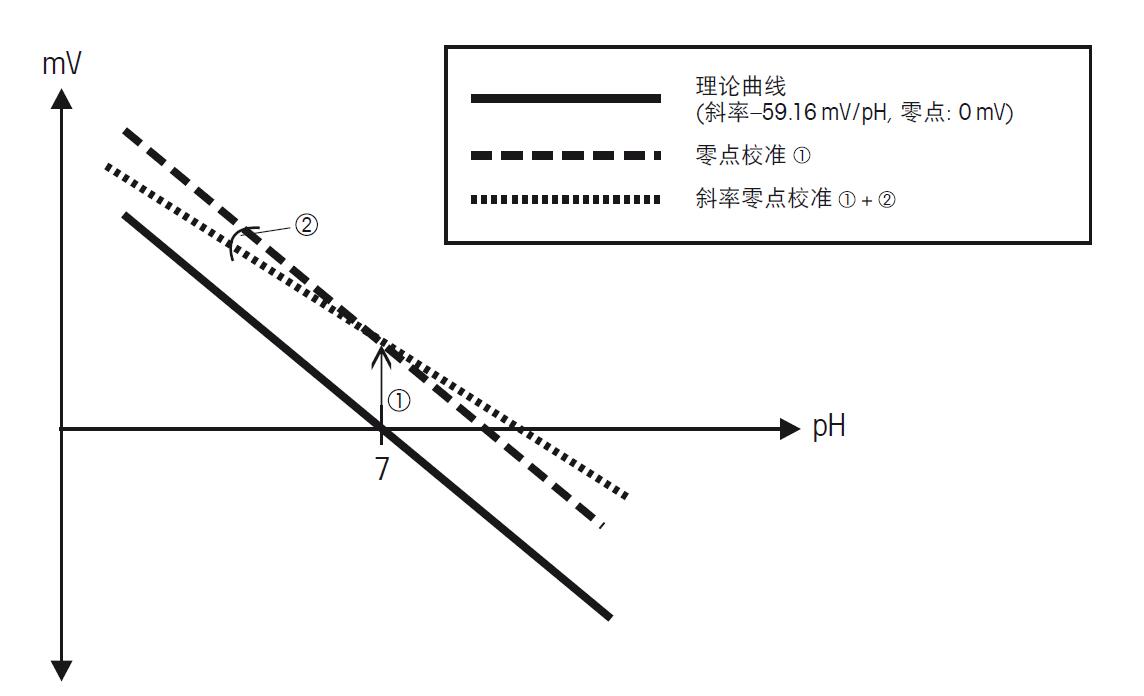
图13. pH电极测量mV值与溶液pH值关联图 该图显示了理论值曲线、零点校准曲线、斜率零点校准曲线 由于每支电极都有其特征性的零点和斜率,为了得到可靠和精确的结果,最少两点校准是必不可少的。当要测量大范围的pH值时,则就需要进行至少3点校准。大多数的pH仪表可以进行3-5点校准。同时所测量的样品pH值落在所选择标准液之中也是非常重要的。 在电极进行校准时,大多数的pH仪表需要输入所用缓冲液的数值。有一些厂家和常用品牌的缓冲液组通常在仪表中会编制成表。这些表格涵盖了不同温度下缓冲液的pH值。这样,校准时只需选择一次缓冲液组,就包括该缓冲液组各个温度下的pH值。梅特勒-托利多缓冲液组的表请见附录5.1。如果没有使用温度探头,需要确保在同一温度下进行校准和测量。这种情况下需要手动输入温度,允许仪表对缓冲液温度进行修正。 用于校准的缓冲液是非常精确的溶液,拥有固定的数值和精度。 缓冲液瓶开封后,为了保证校准的准确性,请依照以下的使用规程: • 第一次使用缓冲液时,在包装上标明日期。 • 保证缓冲液包装的密封性,立即使用倒出的缓冲液。 • 绝对不要把使用过的缓冲液倒回原瓶,或把不同厂家的缓冲液混合在一起。 • 确保没有污染物进入瓶中,保证包装的密封。 • 常温下储存缓冲液。 • 储存时避免阳光直射。 • 校准前请清洗电极,不要在原瓶中直接校准。 • 绝对不要使用过期的或污染的缓冲液,请更换新的缓冲液。 在每次清洁、维护、再生或长时间储存不用后,都会对电极电位产生影响,必须再次校准。 c) pH电极 pH电极决定了pH测量的准确性,所以pH电极状态至关重要。因此为了延长pH电极的使用寿命和结果的精确性,电极的日常维护非常重要。 如果电极使用后不进行清洗或长时间忽略电极维护,电极将不再准确,系统的精确性也很快下降。这点表现为电极斜率逐步下降。 当斜率下降至低于50 mV/pH(等于斜率85%)或零点超过± 30 mV,一些处理方法可以使电极恢复到预期的性能,但为了测量结果的准确性,还是需要更换新的电极。而且包括错误的维护,参比液络部堵塞,电解液流失,玻璃球污染,使用错误的校准缓冲液,都可能导致电极斜率和性能下降。 更多详细的电极维护请看章节2. 温度对于电极也是一个重要的影响因素。电极测量样品的电位部分取决于样品的温度。由于已知温度对pH呈线性关系,所以可以进行补偿。然而当电极与样品间存在温度梯度,就会出现一个问题,导致pH测量的漂移,直到电极温度与样品温度相同,才能获得稳定的读数。如果没有发现这种温度上的差异,就会表现为测量不稳定。若这种不稳定没有被发现,则进行的是非平衡的pH测定。 d) 预期测量的精确度 测量的精确度受到多种因素影响,包括校准时缓冲液的精度,是否使用了温度补偿,是否使用了合适的电极,是否有充足的时间测量, 是否选择了正确的终点与测量模式等等。当这些因素得到了充分的考虑,所测量的精度误差小于± 0.05。 pH测量分步指导 此分步指导以复合pH电极为例。如果使用单独的pH电极和参比电极,确保两者连接在同一仪表上,浸入在同样的测量样品中。 准备 1) 选择适合样品的电极。 2) 连接电极和温度探头至仪表。 校准 3) 打开pH仪表并选择正确的校准缓冲液组或缓冲液值。 4) 如果没有连接温度探头,设置手动温度补偿。 5) 如果没有自动温度补偿,调控正确的缓冲液温度。 6) 在干净的烧杯中倒入足够量的缓冲溶液,准备校准。 7) 保证所使用缓冲液校准顺序,除非pH仪表拥有缓冲液自动识别功能(所有的梅特勒-托利多pH仪表都拥有缓冲液自动识别功能)。 8) 从支架上取下电极,检查电极是否有明显的问题。确保电解液填充口开启,电极内部为常压,保证电解液缓慢地渗入样品中。 9) 使用蒸馏水或去离子水冲洗电极。 10) 轻轻的搅拌第一个缓冲液,并把电极浸入其中。 11) 轻按pH仪表的校准键。 12) 等待数值稳定。梅特勒-托利多仪表都有自动终点模式,数值稳定后,仪表显示会自动锁定。 13) 从缓冲液中取出电极并清洗。 14) 轻轻的搅拌第二个缓冲液,并把电极浸入其中。 15) 轻按pH仪表的校准键。 16) 等待测量终点,屏幕自动锁定。 17) 从缓冲液中取出电极并清洗。 18) 进行第三点校准,重复8)–11)步骤. 校准结束后,轻按仪表相关的键如读数键,退出校准程序。 19) 查询仪表中的校准结果。 20) 保存校准结果。 21) 从缓冲液中取出电极并清洗,放在支架上保存。 测量 22) 在烧杯中倒入足够量的样品溶液保证电极和液络部浸入样品。 23) 保证已知样品的温度或可以通过内置温度探头测得温度。 24) 轻轻地搅拌样品溶液,并把电极浸入样品。 25) 如果样品的温度与电极温度相差太多,确保温度梯度所造成的漂移已经停止,然后才读取pH值。 26) 轻按仪表测量键,等待终点稳定。 27) 取出电极,用蒸馏水或去离子水冲洗。 28) 多个样品重复1)–6)步骤,样品全部测量结束。 29) 测量结束后,用蒸馏水或去离子水冲洗电极,并套上装有参比电解液的保湿帽。 | 产品分类
重点推荐产品
|
 |