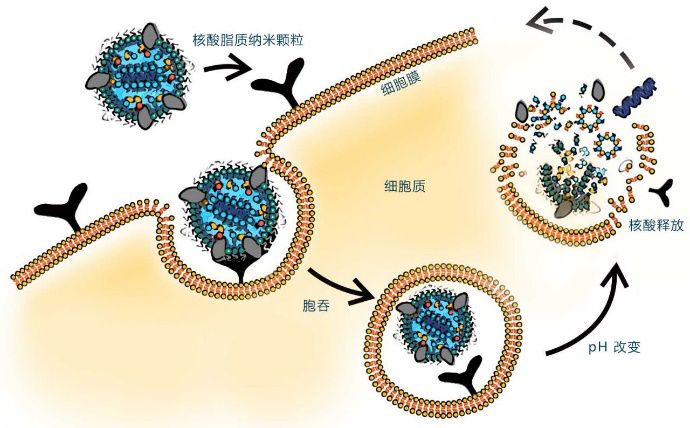
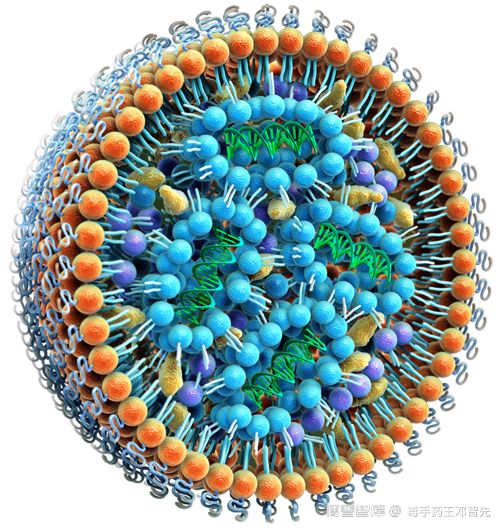
核酸药物递送系统——脂质纳米颗粒(LNP)
作者:AVT 2021.08.27 点击22064次
脱氧核糖核酸(DNA)和核糖核酸(RNA)的主要作用是携带和传递遗传信息。这两类分子能够用于疾病的预防、诊断和zhi疗的,就是核酸药物。核酸药物包括反义核酸(ASO)、小干扰RNA(siRNA)、微小RNA(miRNA)、小ji活RNA(saRNA)、信使RNA(mRNA)适配体(aptamer)、核酶(ribozyme)、抗体核酸偶联药物(ARC)等,是基因zhi疗的一种形式。核酸药物的优点是可以简单地通过重新排列A,G,C,T(U)的序列而成为新的药物。核酸药物能够以化学药物或抗体药物无法靶向(例如mRNA和miRNA)的分子作为作用靶点,有望对传统药物疗效不佳的疾病产生突破性的进展,比如难以zhi疗的遗传疾病、ai症以及某些病毒感(例如SARS-CoV-2)。近期FDA宣布新指南鼓励基因zhi疗(包括核酸药物)创新。诺华、默沙东、辉瑞制药、药明康德等多家药企在该领域进行了重要的布局。 由于疫,mRNA疫苗、核酸药物等获得了更多的关注。现在mRNA疫苗、核酸药物多是采用脂质纳米颗粒(LNP)来实现对mRNA等核酸分子的递送的,辉瑞、Moderna等上市的mRNA疫苗以及早的RNA类药物onpattro都是采用了脂质纳米颗粒来递送各自的核酸药物。本文综述了脂质纳米颗粒在核酸药物递送的作用,组成,关键辅料,制备工艺等方面。 1.核酸药物传递系统是关键 核酸药物的开发主要面临三大问题: 1.1.核酸分子在体内不稳定性; 1.2.核酸分子潜在的副作用; 1.3.核酸药物递送系统开发难度大。 这其中重要的是递送系统的研发。核酸药物在其注射进入人体后,如何存留足够时间以准确靶向到病变部位,同时避免损伤正常细胞,必须是研发出高效安全的药物递送系统,以解决核酸药物递送、稳定性、脱靶效应等难题。递送系统可分为病毒载体和非病毒载体,病毒载体在基因zhi疗中应用较多,但由于其免疫原性、致瘤性、和有限的载药量(loading capacity)使得其在核酸药物中应用相对较少;而非病毒载体应用相对更多,如聚合物类(polymer)、脂质类(liposome或LNP);且可以将核酸药物与特定的配体结合使其能够靶向特定的细胞,如GalNAc、多肽、抗体等。LNP是目前核酸药物研究应用多的递送系统之一,LNP能够安全而有效地递送核酸。目前已经有使用LNP的核酸药物获批,例如Alnylam公司获批的siRNA药物Onpattro。LNP是目前比较成熟的一个技术平台,用来递送RNA药物、疫苗或基因编辑工具。相对其他类型的核酸药物递送系统而言,LNP具有很多优势,比如核酸包封率高并且能够有效转染细胞,组织穿透性强,细胞毒性和免疫原性低,更有利于递送药物等优势,这些优势使LNP成为出色的核酸递送系统。 2.核酸递送脂质纳米颗粒(LNP)的组成 有一些公司在核酸递送系统的脂质配比上是非常相似的,LNP的方中可离子化阳离子脂质占50%,剩下10%是中性脂质,38-40%是胆固醇。脂质纳米颗粒(LNP)模拟细胞膜形成细胞,直径只有100纳米左右,成分包括中性脂质、阳离子脂质、胆固醇、PEG-脂质。核酸药物与普通化学药物的明显区别是核酸有数量庞大的磷酸根,因而呈负电,使用可离子化阳离子脂质的LNP可以更好的包裹核酸药物。阳离子脂质有一个带铵根的亲水端,在酸性下与氢离子结合呈正电,借助两者的静电吸附,就能够将核酸包裹在脂质纳米粒中。当LNP被细胞内吞后,可离子化阳离子脂质会在酸性环境下离子化,破坏内涵体膜,从而实现LNP的内涵体逃逸。LNP还可以设计成特异性结合载脂蛋白如APOE3,APOE3会将LNP带到肝脏,LNP和肝细胞表面受体结合后通过细胞内吞作用释放药物,起到靶向肝细胞的目的,包裹后的LNP外壳因阳离子脂质的疏水端向外而呈疏水性,此时可以加入传统脂质体合成中常用的一端修饰有PEG的脂质——PEG-脂质,使PEG-脂质的疏水端与阳离子脂质的疏水端结合,而PEG-脂质的亲水端(连有PEG)则向外形成核酸脂质纳米粒的外壳。为了增加核酸脂质纳米粒的稳定性,还可以添加适量的胆固醇等成分,使PEG-脂质的疏水端与阳离子脂质的疏水端结合更为紧密,得到核酸脂质纳米粒的成品。 3.核酸递送脂质纳米颗粒(LNP)的关键辅料 核酸递送脂质纳米颗粒一般由以下辅料组成: 3.1.阳离子脂质:与带负电的 mRNA 结合,可高效包载核酸药物,同时提供正电荷,与带负电荷的mRNA复合,有助于内涵体逃逸,mRNA体内转染,可离子化脂质具有pH敏感性。具体产品有DOTAP,Cl,DLin-MC3-DMA,DC-CHOL等。 3.2.胆固醇:稳定LNP结构,调节膜流动性,提高粒子稳定性。 3.3.辅助型脂质:常用DOPE,稳定粒子,破坏内涵体稳定性,提高核酸递送效率。 3.4.聚乙二醇化磷脂:提高粒子稳定性,减少粒子在体内与血浆蛋白的结合,延长体循环时间。例如DMG-PEG2000,DSPE-MPEG2000(药用注射级)等。 3.5.稳定剂蔗糖或海藻糖,提高LNP和mRNA疫苗的稳定性,防止脂质黏性过大。 4. 核酸递送脂质纳米颗粒(LNP)的氮磷比计算 在核酸脂质纳米颗粒合成时,正电荷与负电荷的数量比将影响到纳米粒子的稳定性、电位等性能。正电荷通常为具有可电离铵根(N)的阳离子脂质,而负电荷则为带有大量磷酸根(P)的核酸分子,两者可通过静电吸附的方式结合在一起。两者不合理的比例可能会导致粒径过大、稳定性差等缺陷,正确计算正电荷与负电荷的比(N/P比)是非常重要的。在实际应用中,也可以先定下N/P比,再确定有机相或水相的浓度,此时只需要逆向计算即可。 5. 核酸递送脂质纳米颗粒(LNP)的制备 目前常用的脂质纳米颗粒制备方法主要有薄膜水化法、挤出法、均质法等。有报道采用微流控混合技术来制备核酸脂质纳米颗粒,该方法相对简便快速,条件温和,同时容易实现生产放大。通过不同生产规模的微流控机器,可以较好的实现mRNA-LNP的良好制备,其结果一致性良好,粒径结果合适,且具有极低的PDI值,证实其分散性较好,并且包封效果可达90%以上。通过微流控技术高效、可放大的制备核酸脂质纳米粒,每小时可生产20升。 微流控技术基本原理:将脂质与核酸分别溶解在水相和有机相后,将两相溶液注入制备系统的两条入口通道,一端是RNA的水溶液,一端是脂质的乙醇溶液,通过两相的快速混合,完成核酸脂质纳米颗粒的合成。 改变流体注入速度和比率,可以控制脂质纳米颗粒的粒径大小。 也有文献报道采用类似于微流控技术的冲击式射流混合法可以实现大生产,利用 BlueShadow 80P 高压泵,让疫苗和脂质溶液形成两股射流,在腔体中进行对冲,利用流体动力学让脂质各个组分充分地混合,形成包裹mRNA的纳米脂质体颗粒。生产设备碰撞喷射混合器安装在洁净间(C级)内,通过中控平台控制工艺步骤中所有单元的流量。所有单元安装在不锈钢框架内,以适应药品生产中的 CIP清洁程序。该系统包括:KNAUER 碰撞喷射混合器(IJM), 脂质/乙醇混合物和 mRNA/缓冲液混合物的入口管路,脂质体出口管路,CIP在线清洁系统和不锈钢框架。 6. 核酸递送脂质纳米颗粒(LNP)的专li mRNA核酸技术起源于20多年前,主要来自UBC和UPenn。后面发现LNP可以很好的解决mRNA成药,所以针对LNP专li产生了很多的授权。在阳离子LNP的专li上,一般小核酸领域的企业的专li布局结构为:由母案保护重要的脂质制剂活性成分,分案保护脂质制剂和zhi疗性siRNA的组合,同时由于美国申请存在期限调整的制度,大厂会利用多重专li申请在一定程度上获取不同的延长期限以延长专li对于产品的保护期。因此,在Arbutus前身Tekmira对于MC3脂质体专li进行了详尽保护的前提下,除非对于阳离子脂质设计进行极大变革,很难突破阳离子脂质体专li壁垒。但可以通过替换 LNP 中的其他脂质,规避阳离子脂质的专li壁垒,例如丽凡达生物用阴离子脂质DOPS 替代了 辉瑞和 Moderna 方中的中性脂质 DSPC。 目前国内也发布了一种新型阳离子脂质体专liCN201310099727.5,该专li包含阳离子脂质体核酸类药物制剂及其制备方法和用途。阳离子脂质体方主要包含阳离子脂质,辅助磷脂,聚羧基甜菜碱脂质分子和冷冻保护剂。该专li涉及的阳离子脂质体克服了阳离子脂质体毒性高,血液稳定性差和转染效率低的缺点,有效地提高了核酸类药物的药效,同时由于该制剂使用时不受血清干扰,因此简化了实验和zhi疗中操作。 7.核酸递送脂质纳米颗粒国内发展的问题 对于核酸药物,LNP与其他递送系统相比,其包封效果、体内外表达效果、体内安全性等多方面都更具优势,可以说脂质纳米颗粒(LNP)是佳的递送系统。国内已有多家企业,例如瑞博生物,艾博生物,斯微生物,丽凡达生物, 圣诺生物等均投资研发核酸药物脂质纳米颗粒递送系统关键技术。据报道2020年广州锐博生物技术有限公司投资1016万元,建设核酸药物脂质纳米颗粒递送系统关键技术研究平台,开展核酸药物体内递送系统关键技术开发。 但有三大难题依然制约国内脂质纳米颗粒技术的发展: 1.辅料的缺乏,脂质纳米颗粒辅料的研发,辅料国产化; 2. 缺乏成熟的工业化生产设备; 3.缺乏既懂得制剂学和高分子材料学,又懂得制药工程设备的人才; 如上所述,脂质纳米颗粒LNP作为非常有前景的核酸药物载体,在制药行业已备受关注。特别是现在,LNP是mRNA疫苗的关键技术,在有效保护mRNA并将其运输到细胞当中发挥着举足轻重的作用。同时LNP也应用扩展到其他领域,比如医学影像、化妆品、营养品、农业以及纳米反应器等。随着新辅料的发现,制备工艺的创新改进,LNP会表现出更复杂的内部结构和更优的物理稳定性,未来将会看到更多基于LNP递送的核酸药物上市,为肿liu等多种疾病提供zhi疗方案。 参考文献: 1. Aldosari et al., (2021). Lipid Nanoparticles as Delivery Systems for RNA-Based Vaccines. Pharmaceutics,https://doi.org/10.3390/pharmaceutics13020206. 2. Bioadhesive polymer/lipid hybrid nanoparticles as oral delivery system of raloxifene with enhancive intestinal retention and bioavailability. |[J]Drug DeliveryVolume 28, Issue 1. 2021. PP 252-260 3. Lipid-Based Nanoparticles for Delivery of Vaccine Adjuvants and Antigens: Toward Multicomponent Vaccines. Molecular Pharmaceutics2021. 4.固体脂质纳米粒作为核酸疫苗载体的效应研究,崔正云等人,东北农业大学学报. 2015,46(08) 5.pPB多肽介导的肝纤维化靶向siRNA稳定核酸脂质纳米粒研究,皮玉芳,华东师范大学 本文来自:AVT | 产品分类
重点推荐产品
|
 |